Jelenség leírása
Mérjük meg a glicerin elég híg vizes oldatának fagyáspontját a hígítás (a glicerin tömegszázaléka) függvényében!
Eszközök
hőmérő, mérőhengerek
Magyarázat
1. A mérés elve
Tekintsünk egy m tömegû, x tömegszázalékos oldatot. Kémiai tanulmányokból ismeretes, hogy egy ideális oldat (azaz amelyben az oldott részecskék között nincs kölcsönhatás) Tf fagyáspontja jó közelítéssel lineárisan függ a molaritásban kifejezett koncentrációtól:
Tf=T0 +K.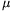 ,
,
ahol T0 az oldószer fagyáspontja, K az oldószerre jellemzõ állandó (K<0), 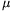 az oldat molaritása (az oldott anyag mólszámának és az oldószer tömegének hányadosa). Az oldott anyag tömege m, az oldószer tömege (1-x).m, így az oldott anyag molaritása
az oldat molaritása (az oldott anyag mólszámának és az oldószer tömegének hányadosa). Az oldott anyag tömege m, az oldószer tömege (1-x).m, így az oldott anyag molaritása
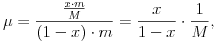
ahol M az oldott anyag moláris tömege. Ezek szerint az oldat fagyáspontja az oldandó anyag tömegszázalékának függvényében:
| (1) | 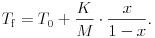 |
A függvényt vizsgálva látható, hogy ha a glicerin vizes oldatát készítjük el, akkor az oldat fagyáspontja a víz fagyáspontja (tehát 0 oC) alatt lesz, mégpedig minél töményebb az oldat, annál alacsonyabban.
2. A mérés leírása
A méréshez szükséges glicerint!!\footnote!![2]A tiszta glicerin adatai (Függvénytáblázat): fagyáspontja 17,8 oC, forráspontja 290 oC, sûrûsége 1260 kg/m3. A glicerin vízben és alkoholban oldódik. Szerkezeti képlete: C3H5(OH)3. gyógyszertárból szereztem be. Ez nem tiszta glicerin volt, hanem annak vizes oldata. (Különbözõ okok miatt tisztán nem forgalmazzák.) Az általam vásárolt 500 g oldat x0=87,7 m/m%-os töménységû volt, sûrûsége 1221 kg/m3. (Ezek az adatok pontosnak tekinthetõk, a gyógyszertár dokumentációja szerint ez a ,,szabványa'' a gyógyszertári glicerinnek.)
Az x0 töménységû oldatot desztillált vízzel hígítva elõállítottam egyenként 150 g tömegû, 5, 10,... m/m%-os oldatokat az alábbi összetételben:
| m/m% | x0 oldat tömege (g) | deszt. víz tömege (g) |
| 0 | 0,0 | 150,0 |
| 5 | 8,6 | 141,4 |
| 10 | 17,1 | 132,9 |
| 15 | 25,7 | 124,3 |
| 20 | 34,2 | 115,8 |
| 25 | 42,8 | 107,2 |
| 30 | 51,3 | 98,7 |
| 35 | 59,9 | 90,1 |
| 40 | 68,4 | 81,6 |
| 45 | 77,0 | 73,0 |
| 50 | 85,5 | 64,5 |
I. táblázat. A vizsgált oldatok összetétele
Ha a fagyáspontot akarjuk meghatározni, nehézségekbe ütközünk, mivel az ,,éppen megfagyó'' oldat megfigyelése és hõmérsékletének mérése egy mélyhûtõben - akár kívül, akár belül tartózkodunk - kellemetlen feladat. A fagyásponttal definíciószerûen megegyezõ olvadáspont mérése azonban kényelmes; az oldatokat fagyáspontjuk alá kell hûteni, és felmelegítve az olvadás során kialakuló hõmérsékletet kell megfigyelni.
A glicerin és a víz tömegét vízszintezett kétkarú mérleggel, hitelesített súlysorozattal mértem ki. Az elkészített oldatokat tiszta mûanyag poharakban fagyasztóba tettem, és megvártam, míg az összes megfagy; ehhez (még a mélyhûtõ leghidegebb, kb. -25 oC-os gyorsfagyasztó üzemmódjában is) több órára volt szükség. Ezután kivettem az oldatokat a fagyasztóból, és szobahõmérsékleten hagytam õket megolvadni, ami leghamarabb a legtöményebbnél következett be. Az olvadás során elõször igen sûrû, kásás állapot jött létre. A folyékony részben összetapadó, zselés kristályok úszkáltak. A hõmérséklet emelkedésével egyre nõtt a folyékony halmazállapotú rész mennyisége, és fogytak a kristályok, így a rendszer egyre tisztult, közelített az eredeti, átlátszó, homogén állapotához. Közben folyamatosan kevergettem az oldatot, hogy egyenletesen olvadjon.
A hõmérséklet mérésére 0,1 oC pontosságú digitális hõmérõt használtam. A hõmérõ fém érzékelõjét az oldatba lógatva folyamatosan lehetett figyelni a hõmérséklet változását. Magának az olvadáspontnak a meghatározása nem könnyû feladat, hiszen azt az állapotot kell megtalálni, amikor a kristályok éppen eltûnnek, és csak a tiszta folyadék marad meg.
3. Mérési adatok
A II. táblázat tartalmazza az I. táblázatban leírt adatok Tf fagyáspontját:
| m/m% | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 |
| Tf [oC] | 0,0 | -1,0 | -2,0 | -3,5 | -5,2 | -6,8 | -8,7 | -10,8 | -13,3 | -16,2 | -19,8 |
II. táblázat. A vizsgált oldatok fagyáspontja
4. A mérési adatok értékelése.
Az 1. grafikon mutatja az (1) elméleti görbét és a II. táblázat mérési pontjait. Az elméleti görbe ábrázolásánál a következõ adatokkal számoltam: a vízre jellemzõ állandó: 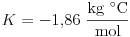 , a víz fagyáspontja T0=0 oC, a glicerin moláris tömege: M=92,1 g/mol.
, a víz fagyáspontja T0=0 oC, a glicerin moláris tömege: M=92,1 g/mol.
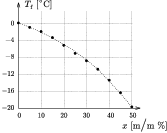
1. grafikon. A glicerin vizes oldatának fagyáspontja a koncentráció függvényében
A grafikonról látható, hogy a mérési adatok igen jól illeszkednek az elméleti görbére. A glicerin vizes oldatának fagyáspontja a glicerin tömegszázalékának függvényében nemlineárisan csökken.
5. A mérés hibája
Az oldatok fagyáspontjára kapott érték hibáját két független hibaforrás határozza meg: a tömegmérés, és ebbõl adódóan a tömegszázalék hibája, valamint a hõmérséklet mérésének hibája.
A kétkarú mérleggel kb. 0,1 g pontossággal lehetett tömeget mérni. Ez azt jelenti, hogy az oldatokban levõ víz és a glicerin tömege 0,1 g-mal eltérhet az I. táblázatban megadottaktól. Ez a glicerin tömegszázalékára nézve még a legrosszabb esetben sem jelent 1%-nál nagyobb hibát, ami a fagyáspontra átszámítva néhány század foknyi hibának felel meg. A gyógyszertárban kapható glicerin és az oldószerként használt, orvosi célra árusított desztillált víz összetételébõl származó hibával együtt ez mintegy 0,1 oC-os hibát jelent a fagyáspontra.
Az oldat fagyáspontjának hõmérsékletét 0,1 oC pontossággal lehetett meghatározni.
Összességében a glicerin vizes oldatának fagyáspontját mintegy 0,2 oC abszolút hibával lehetett megmérni.
Szilágyi Péter (Debreceni Egyetem Kossuth L. Gyak. Gimn., 11. évf.)


